有研究發現,癌症患者通過模擬斷食5天搭配正規治療,可重塑新陳代謝,並加速癌細胞凋亡。放射腫瘤科醫師廖志穎在新唐人《健康1+1》節目中講解,間歇性斷食或模擬斷食,能激活身體抗腫瘤免疫力,同時削弱癌細胞的生存能力,對預防與輔助治療癌症具有潛力。
提高免疫細胞戰鬥力
癌細胞為了快速生長,會大量消耗葡萄糖,並通過無氧呼吸掠奪能量,但同時也需依賴脂肪酸與氨基酸等營養素。因此,廖志穎指出,通過微調飲食進行代謝重塑,是一種可行的策略。雖然無法完全阻斷癌細胞攝取糖分、脂肪酸和蛋白質,因為這些也是正常細胞所需的營養素,但調整飲食比例、內容與攝取時間,可以協助身體激活防禦機制。
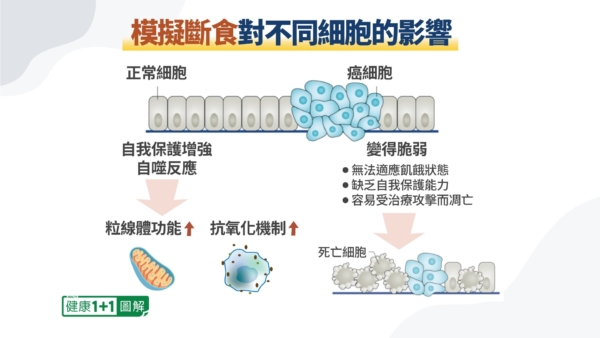
在調整飲食來限制能量供給的過程中,正常細胞具備自噬能力,能在輕度壓力下清除老化細胞與體內廢物,增強自我修復與抗氧化功能,尤其對增強免疫細胞功能有益。相對地,癌細胞因粒線體功能不全,無法適應代謝壓力,更容易受損,進而在化療、放療或免疫治療過程中更容易被消滅。
發表在《癌症發現》(Cancer Discovery)期刊上的一項臨床研究發現,不同類型癌症患者在接受抗腫瘤療法治療時,同時進行5天模擬斷食,結果出現顯著的全身代謝變化,重塑了抗癌免疫力,最終激活多個抗腫瘤免疫程序。
廖志穎表示,模擬斷食並非完全禁食,而是在提供必需的營養素和熱量的基礎上,以攝入較低熱量(約500~600大卡)的方式,營造一個對身體細胞較極端的環境,激活正常細胞再生能力,讓免疫細胞重新活躍起來。此時,正常細胞可以利用酮體與肝醣作為能量來源,維持正常功能,癌細胞則因缺乏替代能量來源而無法存活。這使得放療、化療效果更好,副作用更少。
不過,廖志穎提醒,這項研究處於第二期臨床試驗階段,仍需更多第三期試驗數據佐證,尚不建議癌症患者自行嘗試,應與專業醫療團隊討論評估。
斷食法誘發自噬
自噬反應是人體細胞自我清理與再生的生理機制,當細胞面臨營養缺乏等壓力環境時,會被激活。廖志穎表示,除了模擬斷食外,還有兩類斷食方法可以誘導自噬反應:
1. 間歇性斷食:例如168斷食,即每天16小時斷食,8小時進食,或者進一步延長到18小時或20小時斷食。斷食期間身體會進入能量缺乏的狀態,有機會激活自噬反應。
2. 延長性斷食:即清水斷食,持續3~5天僅喝水,能更明顯地誘發自噬,但這種方式極端,不適合所有人。
廖志穎分享了自己進行間歇性斷食與模擬斷食的經驗。
他表示168斷食比較容易操作,當感到飢餓時,他一般通過飲用無糖咖啡、綠茶或無糖豆漿來緩解。
而在模擬斷食時,他會選用經過科學搭配的代餐產品。廖志穎說,第一天將熱量攝取降至600大卡後,他出現飢餓與疲勞感,主要是由於血糖下降,身體需要通過脂肪或肝醣轉化能量,過程較為緩慢。當需要進行腦力或體力活動時,會感到較為疲憊,因此需大量補充水分以維持代謝。到了第三天,他的身體逐漸適應,並且因為水分減少及脂肪消耗,體重下降約兩公斤。第四天、第五天則需要更多意志力來堅持,因為持續攝取低熱量食物,口感較為單調,類似於在野外求生環境中度日。然而到了第六天,當逐步恢復正常健康飲食時,體能也逐漸回復。
剝奪「天門冬醯胺」能抗癌
還有研究顯示,通過限制特定營養素,可以對抗癌症。台灣長庚紀念醫院的研究團隊,通過限制鼻咽癌患者體內的天門冬醯胺,來抑制腫瘤細胞,同時增強免疫細胞攻擊力,成功讓患者腫瘤縮小甚至消失。這項研究今年3月發表在《自然代謝》(Nature Metabolism)期刊上。
天門冬醯胺是一種非必需氨基酸,肉類、魚類、蛋、堅果等食物中含有大量天門冬醯胺,人體也可以自行合成,並且免疫細胞和癌細胞均依賴天門冬醯胺來支持生長與代謝需求。
廖志穎分析上述研究時指出,限制天門冬醯胺,一方面剝奪了癌細胞的養分,抑制了它的作用能力,另一方面活化了免疫細胞,使免疫細胞進行代謝重塑,轉向更高效的能量代謝途徑,促進記憶型T細胞的生成,更持久地記憶腫瘤特性,進而協助毒殺型T細胞攻擊癌細胞。
由於天門冬醯胺最早是從蘆筍中分離出來,因而有說法指,吃蘆筍會促進癌細胞增殖或增強其存活能力,引起民眾疑慮。廖志穎表示,食物中的天門冬醯胺在經過腸道消化後,原本形式已不存在,反而是人體內自行合成的天門冬醯胺,才是對癌細胞與免疫細胞生長造成影響的來源。
他認為,更關鍵的是研究如何通過藥物去阻斷癌細胞利用天門冬醯胺。不過,這方面研究目前還沒有成熟,因為往往這種限制營養素的藥物,副作用會引起正常細胞的損壞,所以要進到臨床應用階段還有一長段路要走。
提醒大家,因個體差異和實際情況不同,具體治療和處方請咨詢專業醫師。@
身處紛亂之世,心存健康之道,就看健康1+1!
觀賞視頻:
責任編輯:吳宓辰
var scripts_to_load = [];
var contentObj = document.getElementById(“epoch_socail_span”).parentElement;
var iframes = contentObj.querySelectorAll(“iframe”);
if (hasStorage && localStorage.getItem(“EpochOnetrustActiveGroups”).indexOf(“C0005”) > -1) {
if (iframes.length > 0) {
iframes.forEach(function(iframe) {
var dataSrc = iframe.getAttribute(“data2-src”);
if (dataSrc) {
iframe.setAttribute(“src”, dataSrc);
iframe.removeAttribute(“data2-src”);
}
});
}
var fvIframe = document.querySelector(“.video_fit_container iframe”);
if (fvIframe !== null) {
var srcURL = fvIframe.getAttribute(“data2-src”);
if (srcURL !== null && typeof srcURL !== “undefined” && srcURL.length > 0) {
fvIframe.setAttribute(“src”, srcURL);
fvIframe.removeAttribute(“data2-src”);
}
}
} else {
var atag = ““;
var hint = (encoding === “gb” ? (“(根据用户设置,社交媒体服务已被過濾。要显示内容,请”+ atag +”允许社交媒体cookie。)”) : (“(根據用戶設置,社交媒体服务已被过滤。要顯示內容,請”+ atag +”允許社交媒体cookie。)”));
if (iframes.length > 0) {
for (var i = 0; i 0) {
for (var i = 0; i < tweets.length; i++) {
var iTag = document.createElement("i");
iTag.innerHTML = hint;
tweets[i].appendChild(iTag);
}
}
var fvIframe = document.querySelector(".video_fit_container iframe");
if (fvIframe !== null) {
var iTag = document.createElement("i");
iTag.innerHTML = hint;
var parent = fvIframe.parentElement.parentNode;
if (parent) {
parent.insertBefore(iTag, fvIframe.parentElement.nextSibling);
}
}
}