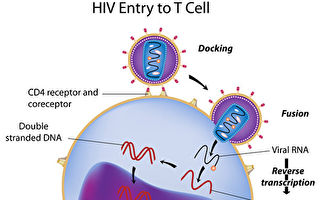
【大紀元記者路小玉編譯報導】據Bay City News報導,上週,美國第九巡迴上訴法院做出一項重要裁決,強化了美國食品藥品監督管理局(FDA)對幹細胞(Stem cell)療法的監管權。專家認為,此舉有助保護患者免受潛在的治療風險。
加州多家幹細胞診所聲稱,通過先進技術可以治療關節炎、阿茲海默症等疾病,吸引了不少患者。然而,部分診所提供的療法未經FDA批准,據不良反應報告,這些療法已導致感染、殘疾,甚至死亡。
幹細胞診所須接受FDA監管
此案件起源於2018年,FDA對位於南加州的加州幹細胞治療中心提起訴訟,指控其診所「不當製造和標籤」未經批准的產品。該診所在蘭喬米拉傑(Rancho Mirage)和比佛利山莊設有分部,主要提供一種從患者體內提取脂肪組織的療法,製造出間質血管分數細胞混合物,並將其注射回患者體內,用於治療如骨關節炎的膝蓋問題。
儘管這種療法未獲FDA批准,診所依然宣傳該技術可治療多種疾病,包括關節炎、帕金森氏症、多發性硬化症及心臟疾病等。這些診所還聲稱,由於療法屬於手術,應豁免FDA的監管。
2022年,一名聯邦法官裁定診所勝訴,認為該療法不屬於藥物範疇。然而,FDA不服該判決並提出上訴,最終上訴法院推翻了原判,確認FDA對這些療法的監管權力。
裁決保障患者安全
上訴法院的裁決對幹細胞診所構成重大打擊,專家指出,這重新確立了FDA對再生醫學領域的權威。加州大學戴維斯分校(University of California, Davis)的細胞生物學教授,保羅·克諾普弗勒(Paul Knoepfler)表示,這項裁決將確保診所無法在未經FDA批准的情況下,隨意使用這些療法。他在接受採訪時提到,在未經FDA許可的情況下,這些細胞不能合法使用。
此外,這一裁決也與此前FDA對佛羅里達一個診所的訴訟結果相呼應,該診所因提供類似療法,而被禁止繼續銷售未經批准的幹細胞產品。這一趨勢表明,未來幹細胞診所面臨的監管壓力將進一步加強。
FDA警告:幹細胞療法有風險
由於幹細胞療法的普及,FDA已多次發布警告,提醒公眾小心選擇療法。FDA表示,目前,只有用於治療血液疾病或癌症的造血幹細胞療法,獲得了批准,其它幹細胞療法尚處於臨床試驗階段。
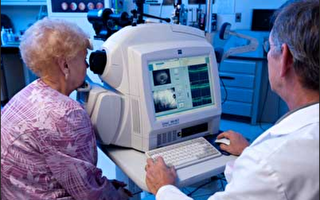
FDA還指出,未經批准的幹細胞療法不但非法,還可能帶來嚴重的健康風險。佛羅里達州發生了一起案件,三名老年女性在接受脂肪幹細胞療法後失明。這些女性因視力問題尋求治療,但手術後出現了視網膜脫落及眼內出血等嚴重併發症。
患者應保持警惕
加州再生醫學研究所((California Institute for Regenerative Medicine,CIRM)也對此發出警告,該機構由選民於2004年批准成立,專門資助幹細胞研究。
CIRM主席喬納森·托馬斯(Jonathan Thomas)指出,儘管幹細胞療法未來有巨大潛力,但目前許多診所過度宣傳其療效,誤導了公眾。
他還表示,目前尚不清楚全加州有多少此類診所在營運,因為他們很難追蹤,只知道越來越多。他提醒消費者,尋求幹細胞療法時,應詢問其是否已獲FDA批准,並對那些聲稱豁免聯邦監管的診所保持高度警惕。因為這些診所通常會通過廣告和其他途徑宣傳未經證實的療法,給消費者帶來迷惑。
FDA及相關機構呼籲公眾在選擇幹細胞療法時,應仔細核實其合法性,避免不必要的風險。◇
本文編譯版權屬大紀元舊金山灣區版報紙和金山紀元網,請勿轉載。